
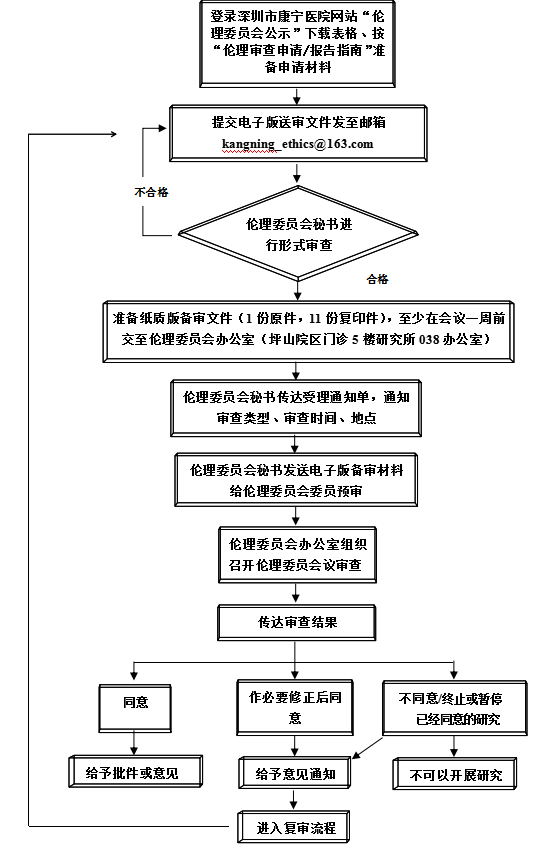
一、提交伦理审查的流程
l.提交送审文件
·准备送审文件:根据附录1,2送审文件清单,准备送审文件:方案和知情同意书注明版本号和版本日期。
·填写申请/报告的表格:根据伦理审查申请/报告的类别,填写相应的“申请”,或“报告”。
·提交:可以首先提交电子版送审文件,通过形式审查后,准备书面送审材料(一份盖章原件及11份复印件),送至伦理委员会办公室。首次提交伦理审查申请的主要研究者,还需要提交资质证明文件复印件。
2.领取通知
·补充/修改送审材料通知:伦理委员会办公室受理后,如果认为送审文件不完整,文件要素有缺陷,发送补充/修改送审材料通知,告知缺项文件、缺陷的要素,以及最近审查会议前的送审截止日期。
·受理通知:送审文件的完整性和要素通过形式审查,办公室秘书发送受理通知,并告知预定审查日期。
3.接受审查的准备
·会议时间/地点:办公室秘书会电话/短信通知。
·准备向会议报告:按照通知,需要到会报告者,准备报告内容,提供15分钟到达会场。
二、伦理审查的时间
医学伦理委员会审查(GCP和科研)会议计划每月召开(无项目顺延至下个月),时间定在每个月最后一个星期三上午10:00时。诊疗技术应用伦理委员会审查(新技术新项目)会议1年召开2次,需要时可以增加审查会议次数。伦理委员会办公室受理送审文件后,一般需要l周的时间进行处理,请在会议审查l周前提交送审文件。
研究过程中出现重大或严重问题,危及受试者安全时,或发生其它需要伦理委员会召开会议进行紧急审查和决定的情况,伦理委员会将召开紧急会议进行审查。
三、审查决定的传达
伦理委员会办公室在做出伦理审查决定后5个工作日内,以“伦理审查意见”的PDF版在线传达审查决定,并通知申请人到伦理办公室领取纸质版。
如果审查意见为肯定性决定(同意继续研究,或不需要采取进一步的措施),并且审查类别属于安全性审查,违背方案审查,暂停/终止研究审查,结题审查,以及上述审查类别审查后的复审,伦理委员会的决定可以不传达。申请人在伦理委员会受理送审材料后一个半月内没有收到伦理委员会的审查意见,视作伦理审查意见为 “同意”或“不需要采取进一步的措施”。
四、伦理审查的费用
药物/医疗器械临床试验项目合同应包括伦理审查费用。科研项目预算应包括伦理审查费。
药物/医疗器械临床试验项目的伦理初始审查费用陆仟元人民币,修正后重审费用陆仟元人民币;跟踪审查为快速审查的不收取费用;跟踪审查为会议审查的,按照每次会议贰仟元收取审查费用。
科研项目的伦理初始审查费用伍佰元人民币(包括初始审查、跟踪审查、复审)。伦理审查费归医院财务科统一管理。